Щавелевая кислота — это вещество органического происхождения. 1824 год — дата открытия C2H2O4 немецким ученым-биохимиком Фридрихом Велером методом выделения из дициана. Относится к классу простейших двухосновных предельных карбоновых кислот. Химическая структурная формула: H2C2O4. Изомеры отсутствуют.

Научное описание
Высококонцентрированное органическое кислотное соединение. Представлено следующими кристаллическими модификациями:
- орторомбической бипирамидальной;
- моноклинной призматической.
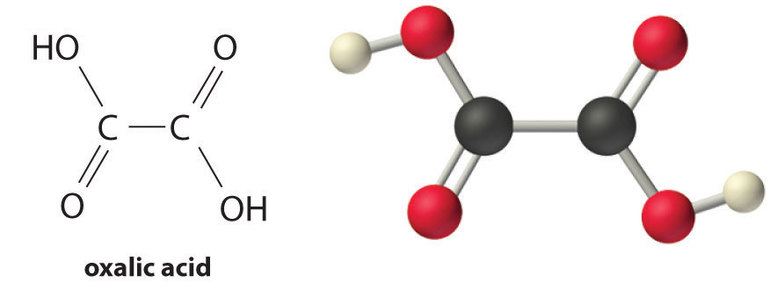
Является горючей. Полностью растворяется в воде, отличается слабой растворимостью в этиловом и диэтиловом спирте. Вещество невозможно растворить в бензоле, хлороформе и петролейном эфире. В природе встречается в виде свободных изомеров, в составе кальциевых солей, эфиров и амидов.
В перечень растений, в которых присутствует этандиоловая кислота, входят:
- карамбола;
- щавель;
- ревень;
- кислица;
- шпинат;
- листовой буряк;
- спаржа;
- какао-бобы;
- петрушка;
- свекла;
- лук-порей;
- виноград;
- сельдерей.
Оксалатами называются сложные эфиры и соли, полученные из вещества.
Щавелевая кислота является токсичной и представляет опасность для жизни.
Физические и химические свойства
Отличается кислым вкусом. Цвет и запах отсутствуют. Температура плавления C2H2O4 — 189,5°C. Воспламеняется при 518 °C. Показатель молярной массы щавелевой кислоты в таблице Менделеева составляет 90,4 г/моль.
Полностью разлагается в процессе нагревания. Реагирует с хлоратом калия, распадаясь на карбонат калия, диоксид хлора, углекислый газ и воду. Вступая в качественную реакцию с раствором аммиака, образует оксалат аммония.

При соединении с йодом можно получить йодоводород и углекислый газ. При реакции с натрием происходит разложение на оксалат натрия, CO2 и H2O. В водном растворе начинается процесс диссоциации на ионы.
Диэтилоксалат и дибутиолксалат, являющиеся производными этандиовой кислоты, применяются для растворения целлюлозы.
Выделить вещество можно одним из нескольких существующих лабораторных методов. Наиболее часто применяемым на практике считаются:
- распад формиата натрия с выделением 2H2O;
- окисление углеводородов, спиртов и гликолей смешанными азотной и серной кислотами с оксидом ванадия;
- процесс окисления жидким оксидом азота.
Меры предосторожности и применение
Щавелевая кислота способна вызвать раздражение слизистых оболочек организма. Взаимодействуя с веществом, необходимо соблюдать меры предосторожности:

Область применения вещества весьма обширна. Соединения щавелевой кислоты задействованы в ряде отраслей промышленности:
- текстильно-кожевенная — окраска шелковых и шерстяных тканей;
- металлургия — чистка металлов от коррозии, накипи, оксидов;
- пчеловодство — обработка пчел;
- бытовая химия — компонент отбеливающих и моющих средств;
- медицина и фармакология;
- аналитическая химия — осаждение редкоземельных металлов;
- сельское хозяйство — инсектицид;
- микроскопия — отбеливание срезов;
- обработка древесины;
- косметология — компонент отбеливающих кремов и масок.
Щавелевая кислота (английское название oxalic acid) — сильное вещество, получаемое в лабораторных условиях и широко применяемое в промышленности. При работе с химическим компонентом обязательным условием является соблюдение мер безопасности.
