Одно из наиболее значимых азотосодержащих соединений — аммиак, степень окисления азота в котором равна -3. Это бесцветный газ, гораздо легче воздуха, с едким прикусом, обладающий резким, неприятным запахом: нашатырный спирт, который используют медики для того, чтобы привести в чувство человека — водный раствор гидроксида аммония, щелочи, полученной от растворения газообразного NH3 в воде.
Получение и основные свойства
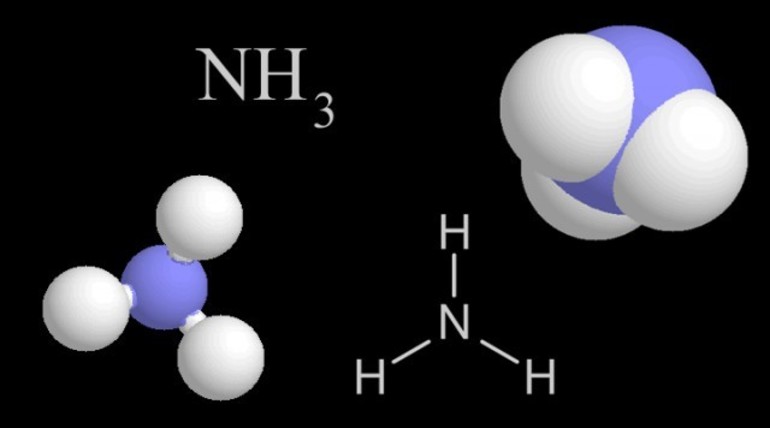
Аммиак — бинарное соединение (вещество, состоящее из двух элементов), в состав которого входят атомы водорода и азота с валентностью III. Молекула по форме напоминает пирамиду: в основании лежит треугольник из водородных атомов, а на вершине — азот. Каждая из трех связей — ковалентная полярная. Основные характеристики:

- NH3 сжижается при -33,35 °C (при высоком давлении сжижается уже при комнатной температуре).
- При -77,7 °C затвердевает.
Получают аммиак несколькими способами. Например, в лабораториях его синтезируют путем взаимодействия солей аммония со щелочами:
- NH4Cl + NaOH → NaCl + NH3 + H2O;
- 2NH4Cl + Ca (OH)2 → CaCl2 + NH3 + H2O.
- NH4HCO3 (гидрокарбонат аммония) → NH3 + CO2 + H2O.
Это каталитические реакции, которые возможны только при нагревании. Здесь степень окисления NH3, а точнее, катиона NH4, во всех соединениях равна +1. Результатом процесса становится образование газообразного аммиака, а также хлорида и воды. Другие способы:

- Термическое разложение гидроксиламина (NH2OH — соединение азота валентностью III) — NH2OH → NH3 + N2 + 3H2O. Реакция протекает при 100 °C.
- Гидролиз нитридов — Ca3N2 + 6H2O → 2 NH3 + 3Ca (OH)2, то есть в результате образуется газообразный аммиак плюс гашеная известь, которая выпадает в осадок.
В промышленности аммиак получают синтезом азота и водорода: N2 + 3H2 → 2NH3. Эта реакция протекает при t=500−550°C, повышенном давлении и в присутствии катализатора, в роли которого используется железо с добавками оксидов алюминия и калия.
Кроме того, это соединение образуется и при коксовании углей (как побочный продукт).
В природе аммиак образуется при разложении азотсодержащих органических веществ. Некоторые количества этого газа можно обнаружить в дождевой воде и в воздухе. Соединение считается малоопасным. Однако превышение его концентрации в водоемах приведет к массовой гибели его обитателей. Именно по этой причине аквариумисты так тщательно следят за тем, чтобы содержание вещества в воде всегда оставалось в норме (определить содержание NH3 можно только с применением специального набора для проверки).
Химические характеристики
Аммиак хорошо растворяется в воде, спиртах, ацетоне, бензоле. Водный раствор NH3 называют аммиачной водой, или нашатырным спиртом. При получении этого вещества происходит реакция термической диссоциации: NH3 + H2O → NH4OH.
Однако последующее нагревание снизит реакционную способность этого газа, и он попросту улетучится.

Аммиак хорошо горит в атмосфере кислорода, хуже — на воздухе, образуя при этом (без катализатора) азот и воду, а при использовании платины в качестве ускорителя процесса — монооксид азота и H2O:
- 4NH3 + 3O2 → 2N2 + 6H2O;
- 4NH3 + 5O2 → 4NO + 6H2O.
При высокой температуре аммиак может взаимодействовать с металлами. В результате образуются нитриды и свободный водород: 2AL + 2NH3 → 2ALN + 3H2.
Гидроксид аммония обладает всеми свойствами оснований. Он вступает в реакцию с кислотами и кислотными оксидами:
- NH4OH + H2SO4 → NH4HSO4 + H2O.
- NH4OH + NH4HSO4 → (NH4)2SO4 + H2O.
- NH4OH + CO2 → (NH4)2CO3 + H2O.
Аммиак легко вступает в реакции с кислотами, образуя при этом аммонийные соли: NH3 + HCl → NH4CL. При нагревании они (за исключением NH4NO2 и NH4NO3) разлагаются на аммиак и кислоту, которые, охлаждаясь, образуют исходную соль
.
Взаимодействие с азотной кислотой дает в результате нитрат аммония: NH3 + HNO3 → NH4NO3. Степень окисления азота в этом соединении равна +5. Полученное вещество — аммонийная селитра — используется как азотное удобрение, и в качестве компонента взрывчатки.
Применение соединения
Аммиак — одно из важнейших азотных соединений. Ежегодно его производят в огромных количествах — более 100 млн тонн. Основная часть произведенного вещества идет на нужды химической промышленности. Что получают с использованием NH3:


- Удобрения.
- Кальцинированную соду — аммиак используется для насыщения солевого раствора.
- Синтез азотной кислоты — в процессе получения требуется аммиак (синтетический).
- Производство нитрата аммония (взрывчатка) — это соединение ведет себя нейтрально при механических воздействиях, однако при определенных условиях оно характеризуется высокими взрывчатыми свойствами.
- Изготовление растворителей, способных реагировать со многими органическими и неорганическими веществами.
- Хладагенты — те, что изготавливают на основе аммиака, наносят меньший вред экологии, чем «привычные» фреоны. Кроме того, аммиачные охлаждающие агенты по стоимости ниже, чем их холодильные «сородичи».
- При производстве средств бытовой химии — например, стеклоочистители, содержащие аммоний, выполняют свою «задачу» гораздо быстрее и качественнее.
- Для производства пятновыводителей (аммиачная вода отлично справляется с различными загрязнениями одежды).
Используется аммиак и в фармацевтической отрасли — для изготовления нашатырного спирта. Это соединение применяется не только как средство для устранения обмороков, но и в качестве рвотного препарата (это незаменимо при отравлениях, особенно алкогольных). Из нашатыря делают различные примочки, им обрабатывают места укуса насекомых.
А хирурги обеззараживают нашатырным раствором свои руки перед операциями.
