Если в сложном химическом соединении присутствуют атомы металла и кислотные остатки, тогда речь касается солей. Не исключено наличие более сложных катионных групп. Соли относятся к разряду сложных веществ, так как в процессе диссоциации образуются катионы аммония либо металла, а также анионы кислотного остатка. Всё зависит от того, в результате чего возникло соединение. На уроках химии в 8 классе изучают таблицу химических свойств солей.

Краткое описание
Все соли (формула — MnAcm) обладают сложным химическим составом, из-за чего могут быть неорганическими либо органическими. Эти вещества получили огромный спрос в разных отраслях современной промышленности. В теоретической химии соли принято разделять сразу на несколько групп:

- Состоящие из анионов и катионов. Речь касается электрической диссоциации.
- Сложные химические соединения могут быть образованы одним либо сразу несколькими кислотными остатками, а также ионом металла.
- Соли могут формироваться в результате взаимодействия кислот и оснований.
К кислотным остаткам помимо металлов могут присоединяться ионы гидроксония, аммония, а также фосфония. В большинстве случаев MnAcm являются твёрдыми кристаллами. Науке известны соли разного цвета (например, зелёные, фиолетовые, белые). Прозрачные кристаллы свойственны для NaCl.
Строение солей отличается наличием кристаллической решётки, которая содержит анионы, а также катионы. Есть и другой вариант. В бесконечную цепочку соединены фрагменты анионов из кислотных остатков. В трёхмерных полостях расположены катионы. Такая структура свойственна силикатам, что отражается на их итоговых характеристиках: неспособность проводит ток и высокая температура плавления.
Дополнительно в молекулах MnAcm могут присутствовать молекулярные ковалентные связи. К особой группе солей относятся ионные жидкости, температура плавления которых ниже 100 °C. Консистенция у этих химических веществ довольно вязкая.
Особенности кристаллогидратов
Все существующие MnAcm отличаются своей классификацией. Швейцарский учёный А. Вернер и российский химик В. Освальд внесли огромный вклад в изучение комплексных солей (КС). В результате проведённых лабораторных исследований удалось определить, что КС состоит из различных частиц. Имеющийся центральный элемент называется комплексообразователем, а все связанные с ним элементы — лигандами. Их итоговое количество рассматривается исключительно как координационное число химического соединения. К лигандам могут относиться не только нейтральные молекулы, но и различные ионы, катионы водорода.
На уроках химии в 8 классе можно узнать, что комплексные MnAcm принято делить на три группы: анионные, нейтральные, а также катионные. Все эти типы химических веществ образуются благодаря разным лигандам:

- Если с комплексообразователем связаны молекулы аммиака, тогда речь касается аммиакатов.
- Сформированные лигандами Н2О аквакомплексы.
- Наличие кислотных остатков свойственно для ацидокомплекса.
Кристаллогидратами принято называются те кристаллы, которые образуются в водном растворе после выпадения солей в осадок. На основании этой реакции базируются многие школьные эксперименты, которые проводятся на уроках химии. Если всё сделано правильно, то между молекулами Н2О и солевыми растворами будут сформированы прочные связи. В итоге образуется кристаллическая решётка. Средние MnAcm можно получить только тогда, когда в кислоте все атомы водорода замещены металлом.
Все химические реакции кристаллогидратов должны быть записаны только в виде количественного соотношения MnAcm и Н2О, разделённых точкой. Например, Na2SO4 ⋅ 10H2O. Если речь касается номенклатуры, тогда для корректного обозначения Н2О должны быть задействованы греческие числа, с которых начинается название. В противном случае будет допущена ошибка. Число должно выступать в роли приставки к слову «гидро», а уже после этого указывается название соли. Например: правильно записать дигидрат сульфат кальция можно только так — CaSO4 ⋅ 2H2O.
Основные химические свойства
Характеристики солей могут существенно различаться, так как всё зависит от состава и принадлежности к определённому подклассу. Для проведения химических экспериментов нужно точно знать, как реагируют друг на друга задействованные вещества.
| Химические свойства солей | Описание | Примеры формул |
| Взаимодействие с активными металлами | Если в пробирку поместить обезжиренный кусок меди и налить небольшое количество нитрата серебра с концентрацией 1:10, то уже через несколько часов на поверхности металла появятся игольчатые кристаллы. | Cu+2AgNO3 → Cu (NO3)2+2Ag↓ 2Al+Cr2 (SO4)3→Al2 (SO4)3+2Cr↓ |
| Взаимодействие с кислотами | Химическая реакция возможна только в том случае, если кислота будет более сильной, нежели задействованная соль. | 2NaCl+H2SO4 → Na2SO4+2HCl↑ |
| Все соли отлично взаимодействуют между собой | В качестве эксперимента можно задействовать хлорид аммония и нитрит свинца. В стакан общей ёмкостью 300 мл нужно налить концентрированный раствор Pb (NO3)2 и поместить в него кристалл NH4Cl. Постепенно в используемой ёмкости начнут расти солевые кристаллы, которые внешне будут напоминать покрытые инеем растения. | NaCl+AgNO3→AgCl+NaNO3 Pb (NO3)2+2NH4Cl→2NH4NO3+PbCl2 |
| Взаимодействие с растворами щелочей | Под воздействием высоких температур многие MnAcm подвергаются разложению. В результате образуется кислотный оксид. Бескислородные соли разлагаются на неметалл и металл. Если реакции разложения будут подвергнуты MnAcm азотистой кислоты, тогда будет выделяться свободный кислород. О2 образуется также при нагревании перманганата калия. | CaCO3 → CaO+CO2↑, 2NaCl →2Na + Cl2↑ 2KMnO4→K2MnO4+MnO2+O2↑ |
Если задействовать оксосоли хлора, тогда под воздействием высоких температур будут образованы хлориды, а также выделится кислород. Газообразный азот и воду можно получить в результате разложения нитрита аммония. После взаимодействия MnAcm с основанием может образовываться другая соль. Химическая реакция: Ba (OH)2+MgSO4 → BaSO4↓+Mg (OH)2. В итоге образуется сульфат бария, который выпадает в осадок.
Физические характеристики
MnAcm — сложные химические соединения, которые при нормальной температуре и давлении являются твёрдыми кристаллами. Все они отличаются по форме. NaCl (поваренная соль) образует кубические кристаллы. Чтобы лично убедиться в правдивости этого утверждения, нужно приготовить концентрированный раствор хлорида натрия.
В небольшой стакан следует налить тёплую воду и добавить 3 столовые ложки соли, которую нужно хорошо перемешать до полного растворения. Часть полученного раствора нужно перелить в неглубокую тарелку и поместить в сухое, прохладное место. Через 3—4 дня вода испариться, а вместо неё останутся кристаллы соли, которые будут иметь идеальную кубическую форму.
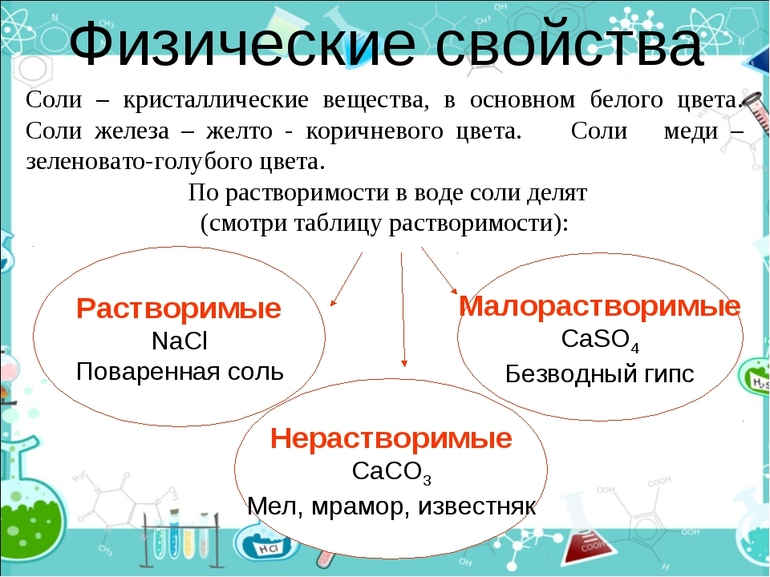
MnAcm различаются по степени растворимости в Н2О. В научной среде существует условное разделение на следующие категории:
- Нерастворимые.
- Растворимые.
- Малорастворимые.
Например, NaCl отлично растворяется в воде. К категории малорастворимых веществ относится CaSO4. Практически не растворяется CaCO3. Цвет солей может отличаться:
- Двухвалентный NiSO4 — зелёный.
- Чистые кристаллы NaCl являются бесцветными.
- СаСО3 — белый.
- PbSO4 — чёрный.
- Кристаллы перманганата калия (KMnO4) отличаются фиолетовым цветом.
- HgS — красный.

Все соли отличаются высокой температурой кипения, плавления. Итоговые показатели зависят от свойств MnAcm. Например, поваренная соль начинает плавиться при +801 °C, а закипает при +1413 °C. Ещё большие значения имеет сульфат калия: плавится при +1069 °C, кипит при +1689 °C. В нормальных условиях MnAcm практически не проводят электрический ток. Но многие приготовленные растворы являются хорошими проводниками.
Кислыми солями называются те химические вещества, которые содержат в своём составе 2 вида катионов: катион металла (или аммония) и катион водорода, а также многозарядный анион кислотного остатка.
Сферы применения
Многие MnAcm в природе встречаются в виде залежей минеральных пород. Например, калийная и поваренная соль, известняк, карналлит, сильвин, мирабилит. Если условно разделить все существующие способы получения солевых веществ, тогда можно выделить физическую переработку полученного сырья, а также извлечение MnAcm из полупродуктов, отходов. В каждом случае действуют свои правила.

В химической промышленности больше всего выпускается солей для сельского хозяйства. Полученные в итоге сложные вещества используются в качестве эффективных удобрений для обработки растений, чтобы ускорить рост и повысить урожайность, а также защитить от вредителей и сорняков. Поваренная соль используется в пищевой отрасли. Она на 97% она состоит из хлорида натрия, а всё остальное — йодиды, остаточные микроэлементы, фториды, карбонаты. Все эти химические вещества очень полезны для организма, но в ограниченном количестве. Минеральные соли являются незаменимым сырьём для серийного производства различных товаров. Например:
- Производство целлюлозы и бумаги.
- Лакокрасочные товары.
- Моющие средства.
- Изготовление прочного стекла.
- Средства для обработки кожи.

В металлургии соли используются в качестве присадок для обогащения руд и выплавки металлов. Без известняка невозможно серийное производство прочного цемента, который является незаменимым материалом в строительной сфере. При изготовлении огнеупорных материалов применяются соли хрома. Гипохлорит натрия является востребованным отбеливателем, а также надёжным средством для обеззараживания воды. Все виды MnAcm применяются в фармацевтической отрасли.
Соли уксусной кислоты применяются в пищевой промышленности, так как эти вещества являются отличными консервантами. Квасцы KCr (SO4)2 активно используются для окрашивания мехов, тканей, а также кожи. Многие виды MnAcm применяются в качестве фиксаналов, когда возникает необходимость правильно определить качество Н2О, химический состав определённого вещества либо уровень кислотности. Вне зависимости от того, в какой сфере используются соли, нужно соблюдать элементарные правила безопасности и не превышать допустимую концентрацию сложных химических веществ, чтобы избежать негативных последствий.
