Главная подгруппа IV группы периодической системы включает элементы: C (углерод), Si (кремний), Ge (германий), Sn (олово) и Pb (свинец). Но основа этого подкласса — углерод, соединения которого встречаются повсеместно и известны человечеству с древнейших времен: драгоценные (алмазы) и полудрагоценные (малахит) камни, угли, органические остатки.

Нахождение в природе
В природе углерод встречается как в чистом виде, так и в форме соединений. В свободном кристаллическом состоянии он находится в виде двух аллотропных видоизменений:

Есть еще одна модификация — аморфный углерод. Это пористое вещество черного цвета. Его «известные представители» — кокс, сажа, древесный и костяной уголь. В чистом виде не встречается, всегда содержит примеси.
В связанном состоянии углерод встречается в карбонатах (кальцит, известняк, мел, мрамор, железный шпат FeCO3, марганцевый шпат MnCO3, цинковый шпат ZnCO3, магнезит, доломит, малахит, и прочие). Кроме того, углерод — основная составная часть каменных и других углей, нефти, горючих природных газов, всех живых организмов.
Основные свойства
Углерод инертен по отношению ко всем обычным растворителям. Исключение — некоторые расплавленные металлы. Однако после остывания он снова кристаллизуется в графит.
При нормальных условиях более химически активный только черный углерод. Он может соединяться со фтором, а при повышении температуры — с водородом, кремнием, серой, бором и некоторыми другими металлами. В результате реакции образуются карбиды:
- 4Al + 3C → Al4C3.
- Ca + 2C → CaC2.
При взаимодействии карбидов с водой или кислотой образуется метан или ацетилен:
- Al4C3 + 12HCl → 4AlCl3 + 3CH4 (метан).
- CaC2 + 2H2O → C2H2 (ацетилен) + Ca (OH)2 (гидроксид кальция).
Ряд карбидов имеет состав, который не подчиняется «общепринятому» представлению о валентности. К таким относится, например, Fe3C.
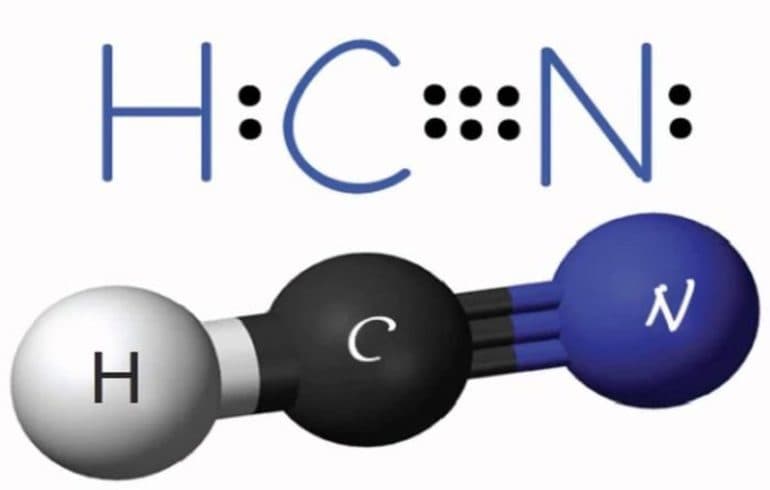
С азотом углерод не соединяется, но в присутствии водорода образует циановодород (формула вещества HCN). В реакциях с кислородом он образует монооксид и диоксид, при этом выделяется большое количество тепла:
- C + O2 → CO2.
- монооксид чаще всего выделяется при пропускании диоксида над раскаленным углем: CO2 + C → 2CO.
Углерод — один из наиболее сильных восстановителей, известных в химии. При взаимодействии с оксидами металлов он «отнимает» у них кислород, восстанавливая при этом вещества до свободного состояния:
- ZnO + C → Zn + CO.
- SiO2 +2C → Si + 2CO.
При взаимодействии избытка углерода с диоксидом кремния (кварцем, песком), кроме чистого Si, образуется карборунд (окись кремния) — очень твердое вещество: SiO2 + 3C → SiC + 2CO.
С галогенами «чистый» углерод не взаимодействует. Соединения с ними образуются из других веществ (например, углеводородов).
Углеродные соединения
В начале XIX века вещества были разделены на неорганические и органические. Ко второй группе относятся углеводороды (метановый, этиленовый и ацетиленовый ряды), белки, углеводы, жиры. Изучением этих веществ занимается органическая химия.
Неорганическая химия изучает другие соединения углерода: галогениды, цианиды, карбиды, оксиды. Наиболее значимыми являются кислородсодержащие вещества — CO, CO2. Есть еще C2O (окись диуглерода) и C3O2 (недооксид), но это пока не слишком изученные вещества.
Монооксид или угарный газ
Оксид углерода 2 (другое название монооксида) — образуется при неполном сгорании C, или продуктов, его содержащих. Его основные свойства:

Монооксид — ядовитый газ, не имеющий цвета и запаха. Его отравляющее действие состоит в том, что он необратимо взаимодействует с гемоглобином крови, в результате чего полностью утрачивается способность переносить кислород от легких к тканям.
В промышленности монооксид получают в процессе газификации твердого топлива. В лаборатории синтезировать соединение можно путем воздействия концентрированной серной кислоты на щавелевую (C2H2O4) или муравьиную (HCOOH). Реакция протекает при нагревании:
- HCOOH → CO + H2O.
- C2H2O4 → CO + CO2 + H2O.
По химическим свойствам двухвалентный оксид — хороший восстановитель. Он отлично горит, выделяя при этом большое количество тепла: 2CO + O2 → 2CO2. Другие характерные признаки:

Угарный газ находит широкое практическое применение. Он входит в состав искусственного газообразного топлива. Кроме того, незаменим при процессах органического синтеза.
Диоксид углерода или CO2
Это газ, не имеющий цвета, обладающий слабым кисловатым запахом и вкусом. Молярная масса равна 44.01 г/моль.
Примечание: оксид углерода 4 в полтора раза тяжелее воздуха, поэтому его можно «переливать» из пробирки в пробирку.
Углекислый газ (еще одно название диоксида углерода) не поддерживает горения. Кроме того, он делает невозможным дыхание: в комнате, где концентрация вещества будет высокой, человек задохнется. Какие свойства присущи соединению:
В промышленности диоксид углерода синтезируют путем термического разложения известняка или мела (иногда доломита, магнезита): CaCO3 → CaO + CO2. Также это вещество можно выделить из коксового газа, при сжигании угля, торфа, нефтепродуктов, древесины. Кроме того, он содержится и в природных источниках: например, «появляется» в результате вулканической деятельности, при распаде органических веществ.
В лабораторных условиях его получают при взаимодействии CaCO3 и соляной кислоты: CaCO3 + 2HCl → CaCL2 + CO2 + H2O (реакция проводится в аппарате Киппа). Другой способ — прокаливание гидрокарбоната натрия: NaHCO3 → Na2CO3 + CO2 + H2O.
Углекислый газ имеет промышленное значение: он необходим в содовом производстве, в пищевой промышленности (изготовление газированных напитков), для синтеза органических кислот. Сухой лед (твердый диоксид) используется в качестве хладагента — углекислая среда предотвращает продукты питания от разложения. Кроме того, CO2 применяется и в медицине (углекислотные ванны для активизации метаболических функций). Незаменим он и для сельского хозяйства — оксид углерода IV участвует в фотосинтезе, поэтому его недостаток негативно сказывается на растениях.
