Углерод – это один из самых важных химических элементов, без которого невозможна жизнь всех живых организмов. Он является основным компонентом всех органических соединений, которые поддерживают жизнь на Земле.
С этим атомом тесно связано понятие «органическая химия», основоположником которой является великий учёный Берцелиус Йёнс Якоб.
Положение углерода в периодической системе химических элементов
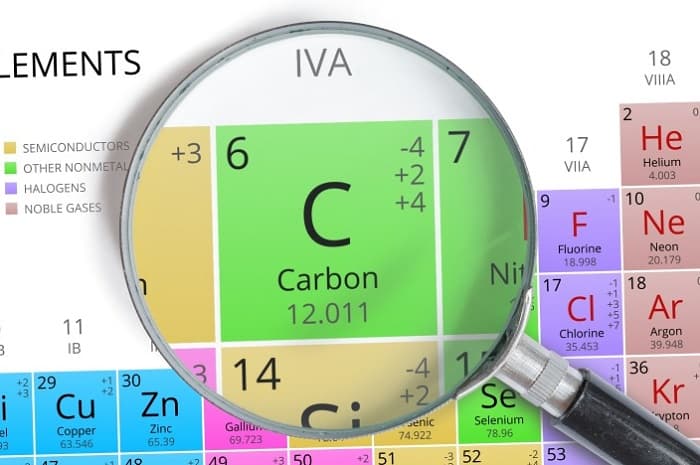
Кратко об углероде (С):
-
порядковый номер атома углерода – 6;
-
он расположен во втором периоде;
-
углерод занимает 4 группу, главную подгруппу (а).
Электронное строение углерода

+6C )2 )4 1s2 2s2 2p2
У атома углерода всего два электронных уровня. На первом расположено 2 электрона, на втором – 4. Всего электронов 6, а значит, заряд ядра будет равен +6.
Атомная масса атома – 12.011.
Степень окисления углерода (-4; -2; 0; +2; +4) зависит от вещества, в котором он состоит.
Примеры:
-
С-4Н4+1;
-
C-2H3+1 Cl-1;
-
C0H+12Cl-12;
-
C-2H+1Cl-13;
-
C+4Cl4-1.
Аллотропные модификации и физические свойства

Рассмотрим 4 основные аллотропные модификации углерода, их формулы и физические свойства.
Алмаз (С)

Физические свойства:
Благодаря своей уникальной кристаллической решётке, алмаз считается самым твёрдым камнем на планете после корунда.
Из твёрдости алмаза следует ещё одно его важное физическое свойство – высокая плотность.
Алмаз отличается своей уникальной теплопроводностью, которая лидирует среди всех твёрдых тел. Кроме того, такая порода не проводит электричество.
Графит (С)

Физические свойства:
-
тёмный, ближе к чёрному цвет;
-
имеет сильно выраженный металлический блеск;
-
прозрачность проявляется в наименьшей степени;
-
имеет огромную температуру сгорания (38500 градусов по Цельсию);
-
температура плавления больше 3800 градусов по Цельсию:
-
теплопроводность 100 — 354 Вт.
Фуллерен (С60)

Физические свойства:
-
плотность 1,68 г/см3;
-
температура плавления 1180 градусов по Цельсию;
-
не растворяется в воде (но растворим в бензоле);
-
плотность 1,69 г/см3;
-
не имеет цвета.
Карбин (CH3OH)

Физические свойства:
-
консистенция – порошок;
-
цвет чёрный;
-
электропроводен (зависит от действия света: чем он больше, тем выше электропроводность);
-
плотность 1,9 -3,30 г/см3;
-
высокая твёрдость и теплопроводность.
Качественные реакции
Цель проведения качественных реакций – выявление наличия нужного атома, вещества или иона.
Рассмотрим их подробнее:
Ca(OH)2 + CO2 = Ca(CO3) (осадок) + H2O – образование вещества, нерастворимого в воде, что свидетельствует о том, что в реакции присутствует углекислый газ.
CaCO3 + 2HCl = CaCl2 + H2O + CO2
– образование углекислого газа, что говорит о присутствии в реакции иона CO32-.
Соединения углерода

Углерод образует два оксида:
1. Оксид углерода (II) – CO. Другое название – угарный газ.
Характеристика: не имеет запаха и цвета. Опасен для жизни живых организмов. Молярная масса – 28,01 г/моль. Получают за счёт окисления углерода кислородом:
C + O2 = 2CO + Q (теплота).
2. Оксид углерода (IV) – CO2. Другое название – углекислый газ, «сухой лёд». Характеристика: без цвета и запаха. Не горит и не поддерживает горения.
C+O2 = CO2 + Q.
Это кислотный оксид, которому соответствует угольная кислота. Молярная масса – 44,01 г/моль.
Карбиды – бесцветные вещества, имеющие форму кристаллов и содержащие в своём составе углерод. Примеры: SiC, Al3C4, CaC2, Cr3C2.
Органические соединения углерода:
-
углеводороды (алкины, алкены, алканы);
-
кислородосодержащие соединения (спирты, кислоты и альдегиды, кетоны);
-
азотосодержащие соединения (нитросоединения, амины, аминокислоты).
Химические свойства углерода
Углерод является и окислителем и восстановителем.

Окислитель:
C0 + 4e = C-4
Примеры:
4Al + 3C0 = Al4C3
C0 + 2H2 = CH4
Восстановитель:
C0 – 4e = C+4
C0 – 2e = C+2
Примеры:
C0 + O2 = CO2
C0 + 2CuO = 2Cu + C+4O2
Углерод – это неметалл, т. е. принимает на внешний уровень недостающие атомы.
Таким образом, значение углерода в жизни всего живого очень велико. Его многочисленные уникальные свойства, различные модификации позволяют использовать углерод во множестве сфер промышленности.
