В соответствии с международной номенклатурой ИЮПАК органические вещества, которые содержат в своем составе карбонильную группу, связанную с атомом водорода и углеводородным радикалом, называют альдегидами. Эти соединения широко используются в промышленности и лабораторном синтезе, это разделение по отраслям применения обуславливает и различие способов получения. Следует рассмотреть основные промышленные и лабораторные способы получения альдегидов с уравнениями реакций.

Получение альдегидов в лаборатории
Все свойства химических веществ зависят от электронного строения их молекул. В карбонильной группе атом кислорода, как более электроотрицательный по сравнению с атомом углерода, перетягивает на себя электронную плотность двойной связи. Это ведет к поляризации связи и появлению частичных зарядов — положительного заряда у углерода и отрицательного у кислорода.

В карбоксильной группе степень окисления углерода равна +1, это промежуточный заряд, который можно достигнуть с помощью окисления или восстановления различных углеродсодержащих веществ. Ряд кислородсодержащих органических соединений с повышением степени окисления углерода, связанного с функциональной группой, выглядит следующим образом:
Спирты → Альдегиды → Карбоновые кислоты.
Таким образом, все лабораторные методы получения карбонильных соединений можно условно разделить на 3 группы:
Синтез ароматических соединений вынесен отдельно только для тех химических взаимодействий, в которых принимает участие бензольное кольцо.
Окислительные методы
В качестве исходных веществ в реакциях окисления используют первичные спирты, дигалогенпроизводные алканов и алкины. При окислении вторичных спиртов получаются кетоны, таким образом, получение альдегидов и кетонов имеет схожий механизм.
Рассмотрим примеры химических уравнений.
- Окисление первичных спиртов оксидом меди или реакция дегидратации (отщепление воды):
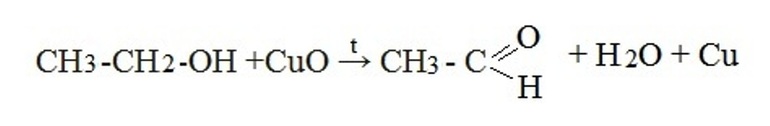
- Окисление спиртов кислородом на медной сетке или дегидрирование (отщепление водорода):
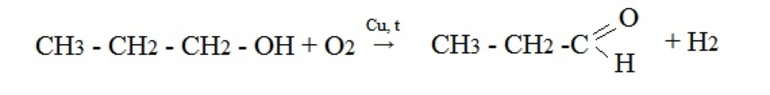
- Реакция Кучерова, или окисление алкинов путем присоединения воды в присутствии солей ртути. При гидратации ацетилена образуется ацетальдегид, при гидратации других алкинов в этих условиях образуются кетоны:
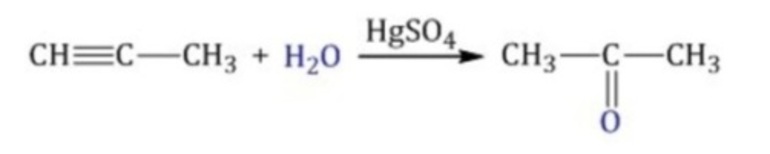
- Гидроборирование алкинов в присутствии щелочного раствора перекиси водорода, в этом случае присоединение происходит против правила Марковникова:
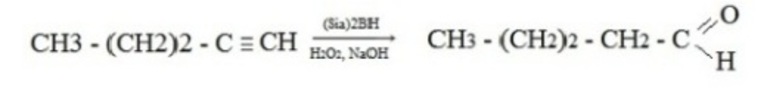
- Гидролиз дигалогеналканов в присутствии раствора щелочи:
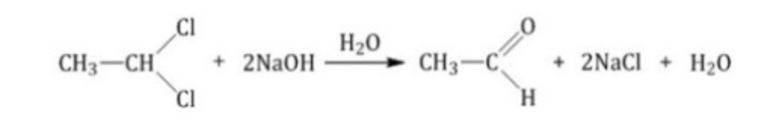
В результате обратной реакции восстановления карбонильных соединений получаются исходные вещества, которые были взяты для их получения.
Например, в результате гидрирования (присоединения водорода) ацетальдегида образуется этиловый спирт.
Восстановительные методы
В качестве исходных реагентов используют производные карбоновых кислот: хлорангидриды, сложные эфиры, амиды и т.п. Например, восстановление водородом хлорангидрида уксусной кислоты на палладиевом катализаторе:
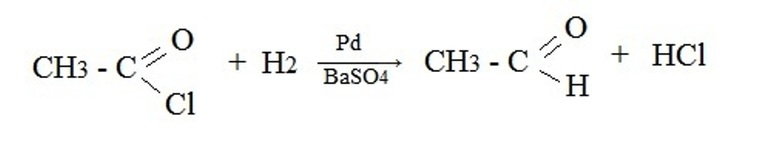
Ароматические альдегиды
Ароматические альдегиды можно получить в лаборатории теми же способами, что и альдегиды жирного ряда. Это могут быть реакции дегидратации и дегидрирования ароматических спиртов, гидролиз дигалогенпроизводных углеводородов ароматического ряда, восстановление производных карбоновых кислот. Уравнения этих взаимодействий будут аналогичны тем, которые были рассмотрены выше.
Специфической реакцией лабораторного синтеза ароматических альдегидов является введение в ароматическое ядро карбоксильной группы – формилирование. Исходные вещества – любой ароматический углеводород, угарный газ плюс хлористый водород, катализатор — смесь хлористого алюминия с монохлоридом меди.
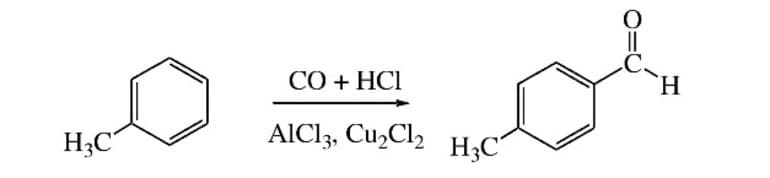
Промышленные способы
В настоящее время известен целый ряд электросинтезов альдегидов, которые перспективны в промышленном производстве лекарственных, парфюмерных, реактивных и других препаратов. Один из наиболее распространенных способов – оксосинтез. Этим способом можно получить карбонильные соединения, содержащие в своем составе три атома углерода и более. В основе реакции лежит гидроформилирование алкенов синтез-газом (смесь угарного газа с водородом).
Продуктами оксосинтеза является смесь альдегидов, соотношение которых можно изменять в результате подбора соответствующих катализаторов.
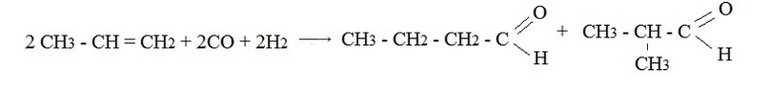
Дегидрирование первичных спиртов используется в промышленности только для получения уксусного альдегида. В качестве сырья выступает этиловый спирт, важным условием реакции является наличие катализатора (медь, активированная церием) и высоких температур в пределах 270-300˚С. За один цикл в реакцию вступает 25-50% этанола, выход продукта составляет 90-95%. В виде побочных продуктов реакции образуются этилен, этилацетат и высшие спирты.
При производстве формальдегида (метаналя) используется процесс окисления муравьиного спирта при температуре 400-450˚С, одно из условий – избыток кислорода. В качестве катализатора выступают оксиды железа и молибдена.
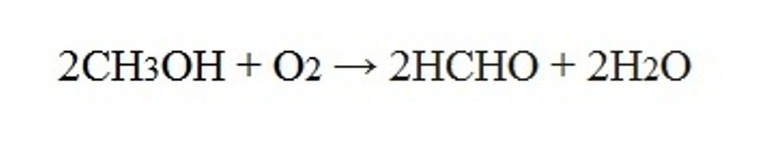
Получение ацетальдегида в результате гидратации ацетилена потеряло свое промышленное значение. Причиной является высокая токсичность катализатора реакции – ртути сернокислой. Ацетальдегид и акролеин в промышленности получают в результате окисления алкенов. Реакция проходит в присутствии смеси хлоридов палладия и меди. В качестве сырья для получения уксусного альдегида используют этилен, для получения акролеина – пропилен.

Основным сырьем для получения различных ароматических карбонильных соединений является бензальдегид. Промышленное получение бензальдегида основывается на реакции гидролиза бензальхлорида. В качестве гидролизующих агентов используют углекислые соли натрия или кальция, гидроксиды натрия или кальция, а также кислоты с добавлением соответствующих солей металлов.
Использование тех или иных методов получения альдегидов обусловлено процентом выхода продукта химической реакции, доступностью исходного сырья и возможностью соблюдения условий синтеза.
