Химические простые частицы имеют определённое направление и могут связываться друг с другом при помощи образования особых взаимодействий. Есть ковалентная полярная и неполярная связь веществ. Любая из частиц имеет своеобразный путь своего формирования и обстоятельства появления. Их взаимодействие в одно и то же время возникает из пары электронов, являющихся принадлежностью к обоим атомам. Ковалентные связи могут появиться в случае объединения орбиталей.
Концепции и немного истории
Валентность показывает на присутствие конкретной силы. Появление подобной связи случается через обобщение атомных электронов, у которых нет «пары». Ковалентная связь случается между атомами неметаллов и может быть замечена как в молекулах, так и в кристаллах.
В первый раз ковалентность была открыта в 1916 г. химиком из Америки Дж. Льюисом, и прошло некоторое время, пока сформировалась гипотеза, а потом её смогли обобществить, и она была доказана опытным путём. Химики узнали, что это за прецедент, при котором выявили: электроотрицательность неметаллов довольно велика, и при содействии 2-х физических атомов притягивание электронов может быть сложной задачей и даже неосуществимой, поскольку они в 2-х атомах соединяются, и между ними случается ковалентность атомов.
Типы ковалентной связи

Характеристика ковалентности — это действие, которое случается в веществах с неметаллическими качествами. Выявляется она при совместном участии атомных электронов в различных элементах. Схема образования ковалентной полярной связи — взаимодействующие атомы имеют различный способ электроотрицательности, а открытые электроны не принадлежат тождественно 2 атомам.
Большую часть времени электроны приближаются к первому атому, чем ко второму. Случаем ковалентности полярной могут быть взаимодействия, которые выявляются в молекуле хлористого водорода, где раскрытые электроны в ответе за ковалентность и ближе к атому хлора, чем водород. И дело в том, что электроотрицательный показатель у первого вещества выше, чем у второго. Хорошим примером ковалентной полярной связи будет вода.
Эти одинарные химические взаимодействия происходят из-за появления накопительных молекулярных частей электронов, которые являются общими для двух взаимодействующих частей. Появление электронных пар связано с перекрытием орбиталей. Такие типы взаимодействий в химии происходят между частями обоих элементов.
Вещества со строением такой структуры:
- газы;
- вода;
- алкоголь;
- углеводы;
- белковая пища;
- кислотная органика.
Ковалентность появляется методом открытия пар электронов в несложных субстанциях или же сложных соединениях.
Чтобы квалифицировать природу кристаллической химической связи, надо взглянуть на атомную составляющую частиц, находящихся в формуле. Взаимодействия описанного типа образуются лишь только между веществами, в которых доминируют неметаллические качества. В случае если слияние имеет атомы похожих или же различных неметаллов, то взаимодействия между ними считаются ковалентными.
Полюсное взаимодействие
Когда в соединении совместно есть металл и неметалл, выявляется, что элементы образуют ионное соединение. Ковалентная полярность связывает решётку атомов всевозможных неметаллов друг с другом.
Это бывают атомы:
- хлора и водорода;
- фосфора и кислорода;
- аммиака.

Есть другое определение таких веществ. Это говорит о том, что кратная цепь возникает между неметаллами с разными показателями электроотрицательного появления. В 2-х случаях возможно выделить многообразие атомов, где была замечена эта связь.
Выставленные соединения в нормальных критериях наличествуют в водянистом или же газообразном агрегатном состоянии. Формулы Дж. Льюиса могут помочь понять устройство и насыщаемость связывания атомных ядер.
Действие получения ковалентности для атомов с разными значениями электроотрицательности объединяется к образованию совместной плотности электрического состояния. Как правило, он сдвинут к составляющей, что содержит самую возвышенную степень электроотрицательности. По причине возникающего смещения всей пары в направленности вещества с большим числом электроотрицательности в нём отчасти появляется негативный заряд. Вследствие этого, появляется слияние с 2-мя по-разному заряженными полюсами. Нередко при формировании полярных отношений применяется акцепторный или же донорно-акцепторный механизм.
Путь образования ковалентных связей:
- Акцепторный (обмена). Любой атом выделяет 1 неспаренный электрон.
- Донорно-акцепторный ковалентный тип. Один атом (донор) гарантирует электрическую пару, а акцептор орбиталь для неё.
Устройство образования ковалентных связей описывается как конфигурация взаимодействия, свойственная не для всех полярных соединений. Примерами считаются вещества органического и неорганического происхождения.
Неполярная структура
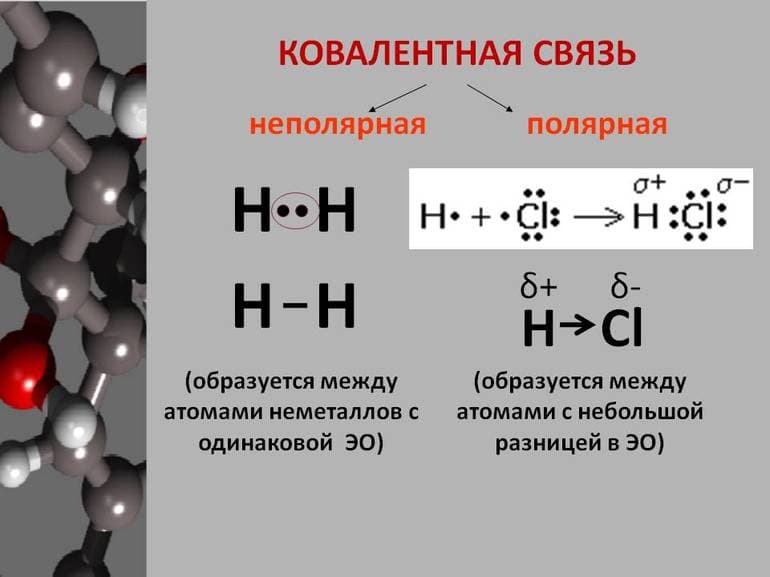
Неполярная ковалентность связывает составляющие с неметаллическими качествами, что точно так же равно электроотрицательному значению. Другими словами, элементы с неполярностью предполагают собой соединения, состоящие из различных чисел похожих неметаллов. Формула вещества с ковалентной неполярной связью: N2.
Примером ковалентной неполярной связи считаются вещества простой структуры: О2, N2, Cl2. Составление этого типа взаимодействия и других неметаллических частей включает экстремальные электроны. Валентность относится к количеству электронов, важных для окончания обычной наружной оболочки. Атом имеет возможность предоставить или же получить негативно заряженные частички.
Эта работа относится к уровню двухэлектронных или же двухцентровых цепей. В этом случае пара электронов занимает общую долю между 2-мя орбиталями. В структурных формулах пара электронов записывается в виде части по горизонтали. Каждая связь демонстрирует количество общих пар электронов в молекуле. Потребуется затратить наибольшее число энергии для разрушения с помощью этой связи, вследствие чего эти вещества станут одними из самых мощных по шкале крепости.
По донорно-акцепторному механизму неполярные части буквально не связаны. Ковалентная неполярная связь представляет собой структуру, образующуюся совместными электронными парами. Эти пары в равной степени принадлежат 2 атомам.
Однообразие ковалентных неполярных и полярных связей заключается в возникновении абсолютной электрической плотности. Лишь только в ином случае приобретённые электрические совместные части в равной степени принадлежат 2 атомам, занимающим центральное состояние. В итоге выборочные положительные и отрицательные заряды не образуются, что значит полученные цепочки считаются неполярными.

Неполярность приводит к образованию совместной пары, в итоге конечная степень атома будет законченной. Качества этих веществ, имеющих определённые структуры, выделяются от тех, что с металлическими или же ионными взаимодействиями. В обменном процессе ковалентности между атомами любой из них представляет собой один неспаренный электрон, образующий электрическую ковалентность. В этом случае они могут иметь обратные заряды.
Случаем подобной ковалентной связи могут быть взаимодействия, которые видятся в молекуле водорода. Когда атомы вещества намереваются совместно действовать, их электрические части попадают друг в друга. В итоге плотность между ядрами возрастает, они сами притягиваются, а энергия системы миниатюризируется. Впрочем, в случае если ядра делаются очень близкими, они начинают отталкиваться, и, таким образом, между ними появляется подходящее расстояние.
Что касается донорно-акцепторного вида ковалентности, то это случается, когда 1 из частиц, донор, предположит собственную электрическую пару для связи, а 2-я, акцептор, считается свободной орбиталью.
Квалифицирование ковалентности

Смысл ковалентной неполярной связи такой — это взаимодействие, которое появляется между похожими атомами. В молекулах с неполярной ковалентностью совместные пары электронов находятся на равных расстояниях от атомных ядер. К примеру, в молекуле воздуха атомы имеют 8 электрических конфигураций, в то время как они имеют 4 совместные электрические пары. Препараты с неполярной ковалентностью, как правило, предполагают собой газы, воду или же сравнительно низколегированные твёрдые вещества.
Чтобы верно квалифицировать ковалентную полярную и неполярную связь, достаточно понять свойство и формулу молекул, в случае, если они состоят из атомов различных составляющих, взаимодействие будет полярным, а если из 1-го, то станет неполярным. Ещё надо знать, что неполярные связи в целом могут встречаться лишь только между неметаллами, и это связано с механизмом ковалентных взаимодействий.
