В науке известно несколько видов оксида азота. Некоторые из них используются в медицинской практике и промышленных целях. Часть соединений крайне неустойчивы и не имеют практического значения. Химические вещества этой группы оказывают воздействие на организм человека и принимают участие в обмене веществ.
Виды и свойства
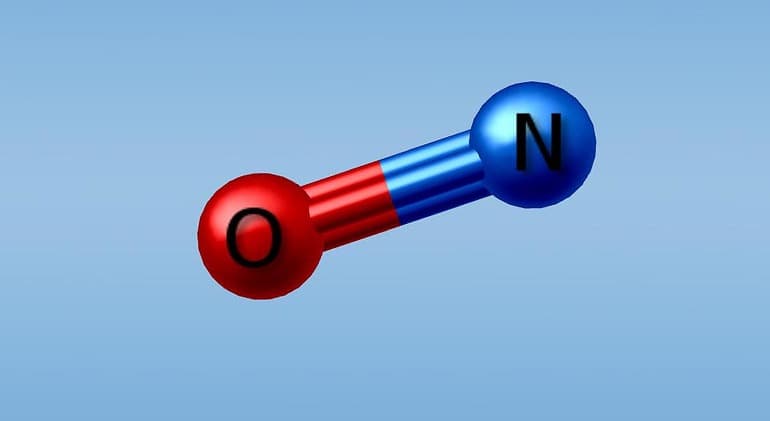
Азот — вещество, которое образует несколько групп оксидов. Все они обладают разной молярной массой и физическими характеристиками. В группу солеобразующих входят:

Связи атомов происходят по механизму «донор-акцептор». Атом азота отдаёт электрон и приобретает заряд со знаком «плюс». Кислород присоединяет электрон, приобретая отрицательный заряд.
Несолеобразующие соединения
Второй класс соединений — несолеобразующие. В неё входят оксид одновалентного и двухвалентного азота. Вещество с формулой N2O имеет линейное строение молекулы. Представляет собой газ, не имеющий цвета. В нормальных условиях вещество инертно. Обладает сладковатым вкусом и слабым запахом. Легко растворяется в воде, однако не вступает с ней в химические реакции. С водородом реагирует со взрывом. Не вступает в химические реакции с кислотами и основаниями.
При небольшом нагревании быстро разлагается, проявляет свойства окислителя. Окисляет металлы, водород, сернистый газ и прочее. Растворяясь в воде, образует азотную кислоту. В результате таких реакций образуется свободная форма азота.
Вступая в контакт с окислителями, N2O выступает в роли восстановителя. К примеру, раствор перманганата в серной кислоте окисляет закись азота до образования монооксида. В водном растворе окисляет диоксид серы до серной кислоты.

Монооксид (II) — NO. При низких температурах молекулы димеризуются и образуют новое вещество. Окись азота представляет собой газ без цвета и запаха, малорастворимый в воде. В присутствии кислорода загорается, образуется диоксид — вещество коричневого цвета. Под действием хлора или озона легко окисляется. Жидкая и твёрдая форма имеет голубую окраску. Вступает во взаимодействие с основаниями и основными оксидами.
Вступает в химические связи с окислителями, водородом, активными металлами. Входит в состав выхлопных газов автомобилей в качестве побочного продукта.
Получение в природе и промышленности
В природе азот встречается преимущественно в чистом виде. Во время грозы азот и кислород вступают во взаимодействие при высокой температуре. Образуется монооксид: N2+O2 = 2NO.
В промышленных условиях получают следующие соединения:

Живые организмы также вырабатывают соединения азота. Растения способны вырабатывать монооксид азота несколькими способами:
Практическое применение
Химические свойства оксида азота нашли практическое применение. Их используют в медицинской практике, военной, пищевой и химической промышленности. Наиболее часто соединения используются в следующих целях:
Влияние на живые организмы
В смеси с кислородом закись азота в малых концентрациях воздействует на нервную систему человека. Эффект напоминает опьянение лёгкой степени и сопровождается эйфорией. За это веществу дали название — «веселящий газ». В чистом виде вещество вызывает состояние опьянения и выраженную сонливость. При передозировке вначале вызывает приступ судорожного смеха, затем потерю сознания.
Монооксид азота — высокотоксичное соединение. Поступая в организм в больших концентрациях, способен изменить структуру гемоглобина, что взывает кислородное голодание. Оксид азота (IV) — крайне ядовитое вещество, представляющее опасность для здоровья и жизни.
Монооксид азота — вторичный посредник, который участвует в механизмах внутриклеточной и межклеточной передачи импульсов. Это вещество вырабатывают практически все живые организмы, от одноклеточных до млекопитающих.
Изначально окись азота была известна как эндотелиальный сосудорасширяющий фактор. Она образовалась в организме из аминокислоты аргинина. В химическом процессе участвуют молекулы кислорода, НАДФ и синтаза оксида азота. Другой способ образования вещества — восстановление неорганических солей азотной кислоты.
Эндотелиальные клетки сосудов передают сигнал гладкомышечным элементам, в результате сосуды расширяются и усиливается местный кровоток. Молекула оксида азота обладает способностью легко проникать через мембраны клеток. Благодаря этому она служит для обмена сигналами. Это благотворно влияет на состояние сердечно-сосудистой системы. Снижается риск ишемии миокарда и развития гипертонической болезни.
Уровень эндогенной окиси азота могут повышать растительные продукты — руккола, шпинат, свёкла, петрушка и прочие. Получение вещества из растительных продуктов требует присутствия сапрофитных микроорганизмов. В норме они живут в ротовой полости человека.
